
近日,为应对疫情爆发期间的个人防护用品以及医疗器械的短缺问题,美国及欧盟委员会可接受短期内符合性评定的授权克减操作,前提是要确保产品达到足够的健康和安全水平。
为了帮助国内企业更好理解应急授权的核心要求,并掌握识别公告机构的能力,我们对应急程序建议进行简要解读,提供公告机构授权的识别方式。
美国及欧盟防疫物资,开启绿色通道解读
美国
3月中发布正式EUA审批流程(即审批流程加急)疫情期间所需的医疗防疫产品如:口罩和防护服、体温计等,FDA可能会考虑加速审查生产地点变更或上市前申请,相关的制造商可与FDA联系获取官方指引。
与FDA官方联络的邮件要求:
制造商可以通过eviceshortages@fda.hhs.gov向FDA发送电子邮件,为了快速收到FDA的回复,请参考以下FDA认为有帮助的信息示例:
邮件主题:“产品代码XXX,FDA短缺缓解选项,”其中XXX代表产品代码。
邮件正文:
描述受影响的产品,可能包括品牌名称、型号510(k)号等。
描述拟议的缓解措施。
明确您想要与FDA讨论的内容,如:
加速审查上市前提交的文件或如果您是III类设备制造商,则可加速审查生产场地的变更或有关进口某些产品的信息
根据FDA官方的规定,适用的产品代码如下:
1. 外科口罩 (FXX)
2、带有抗菌剂/抗病毒剂的外科口罩 (OUK)
3、儿科/儿童口罩 (OXZ)
4、手术服 (FYA)
5、隔离服和或者配件 (FYC, LYU, OEA))
6、外科服 (FXO)
7、体温计 (FLL)
递交申请(附相关资料)----FDA根据产品类型提交需要注册的资料清单----企业按要求递交相关资料----FDA对其进行审批-----企业根据要求进行整改------FDA最终做出决定;
3月17日,美国CDC发布了对N95口罩的供应策略。详情可见:
https://www.cdc.gov/coronavirus/2019-ncov/hcp/respirators-strategy/crisis-alternate-strategies.html

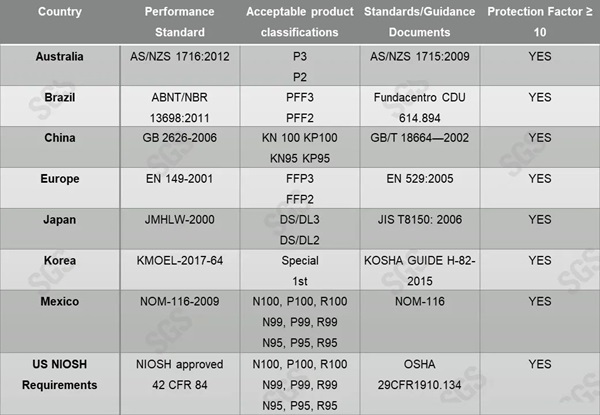
策略称,当N95供给不足时,可使用使用超过制造商指定保质期的N95口罩进行医疗活动。通过其他国家标准评价的N95口罩,这种评价与NIOSH类似,因此美国也可以使用这类N95口罩。
各国评价标准如下:
欧盟--紧急发布防疫产品的符合性评定和市场监督程序建议
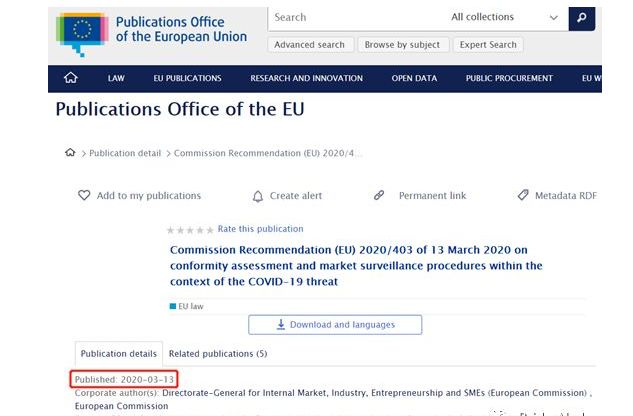
欧盟委员会于2020年3月13日发表关于COVID-19威胁下的符合性评定和市场监督程序的建议(Commission recommendation (EU) 2020/403)。
建议表示,为应对疫情爆发期间的个人防护用品以及医疗器械的短缺问题,欧盟委员会可接受短期内符合性评定的授权克减操作,前提是要确保产品达到足够的健康和安全水平。
该建议重申了各种个人防护用品和医疗设备归属的法规和指令,制造商应依据相应的法规和指令,申请执行适用的符合性评定程序,证明其产品符合基本健康和安全要求,才能将个人防护用品和医疗器械贴附CE标识投放欧盟市场。
应急审批法规Commission Recommendation (EU) 2020/403,原文网址:
https://eur-lex.europa.eu/legal-content/EN/TXT/?qid=1584691656525&uri=CELEX:32020H0403
个人防护装备欧盟法规(EU)2016/425范围内的防疫产品包括:
一次性和可重复使用的防固体颗粒的呼吸器/面罩
注:防护类口罩必须获得公告机构Module B(型式检验认证)+ Module C2(内部质量控制+产品随机性监督抽查)or Module D(生产过程质量控制)证书后,方可在欧盟合法销售。
一次性和可重复使用的防护服
注:灭菌医用防护类口罩必须获得公告机构Module B(型式检验认证)+ Module C2(内部质量控制+产品随机性监督抽查)or Module D(生产过程质量控制)证书后,方可在欧盟合法销售。
- 用于预防和保护病毒等有害生物制剂的手套和护目镜等
注:医用手套及护目镜口罩必须获得公告机构Module B(型式检验认证)+ Module C2(内部质量控制+产品随机性监督抽查)or Module D(生产过程质量控制)证书后,方可在欧盟合法销售。
以上,通俗理解必须Module B + Module C2 或 Module B + Module D二选一
医疗器械指令93/42/EEC以及将在2020年5月26日起生效的替代法规
(EU) 2017/745范围内的产防疫品包括:
- 外科口罩(灭菌需要公告机构审核)
- 检查手套(灭菌需要公告机构审核)
- 部分隔离防护服(灭菌需要公告机构审核)
- 呼吸机(需要公告机构审核)
- 测温仪(需要公告机构审核)
- 制氧机
- 等
重点解读
为了确保在COVID-19疫情期间提供适当的个人防护用品和医疗设备,欧盟委员会邀请整个供应链中的所有经济经营者,以及公告机构和市场监督机构,部署其可支配的所有措施,支持旨在确保整个欧盟市场的个人防护用品和医疗器械供应与不断增长的需求相匹配。然而,此类措施不应对整体健康和安全水平产生不利影响,所有相关利益相关者应确保任何正在投放欧盟市场的个人防护用品或医疗器械继续为用户的健康和安全提供充分的保护。
1、建议而不是法规,即不具有强制性;
企业是否有资格进入紧急采购通道,必须与目标市场的进口商和监管机构提前沟通,否则可能会无法清关。
2、成员国监管机构认为满足基本安全和性能要求(相关要求可参考欧盟法规)的PPE(个人防护用品)或Medical Device(医疗器械)但不包括IVD (如:试剂盒),即使没有完成符合性评价流程、尚未标CE Mark,也可以允许在特定时期内上市,同时该产品必须继续完成其符合性评价过程。
3、成员国当局也可在疫情期间评估和组织采购没有CE标识的个人防护用品和医疗器械,但是该类产品仅可提供给医疗工作者使用,不能在市场上流通销售。
4、欧盟委员会同时在<建议中>强调市场抽查将会重点抽查防疫相关个人防护用品和医疗器械,以防止不合格产品导致严重风险。
公告机构授权的识别方式
以上产品大多需要公告机构审核及发证,那什么样的认证机构可以提供呢?
个人防护装备
只有获得欧盟委员会 (EU) 2016/425 PPE法规口罩产品Module B、Module C2和/或Module D授权的认证公告机构,才有权从事防护口罩的CE认证活动。
任何无PPE法规授权的认证公告机构、不具备Module B、C2和/或D资质的认证公告机构、不是认证公告机构的中介机构,都没有权力进行防护口罩的CE认证活动。
医疗器械指令
只有获得欧盟委员会 (EU)93/42/EEC以及将在2020年5月26日起生效的替代法规(EU) 2017/745机构,才有权从事医疗器械的CE认证活动。
目前,国内暴露出来比较突出的问题是大量无资质的认证机构和中介机构,利用企业对于欧盟法规的不了解,误导企业进行错误的选择,签发了大量无效的CE证书,使得企业在出口欧盟过程中,面临了巨大的商业风险和法律风险。
确认一个认证公司是不是正规PPE CE 或MDD CE认证机构,查询欧盟官方网站查询公告机构信息。
第一步:
查询公告机构信息
欧盟委员会授权认证公告机构对外公示信息,企业依公告机构编码,查询该机构的信息和授权范围。
欧盟官网:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=notifiedbody.main
第二步:
确认公告机构的授权范围
每个认证须在授权范围下颁发证书,如超范围发证其签发的证书也是不符合欧盟法律规定的。
PPE法规 (EU)2016/425的授权,其资质范围的展示如下:
![]()
MDD指令Directive 93/42/EEC的授权,其资质范围的展示如下:
![]()
MDR法规(EU)2017/745授权,其资质范围的展示如下:
![]()
第三步:
确定认证公告机构认证范围
PPE法规(EU)2016/425的授权
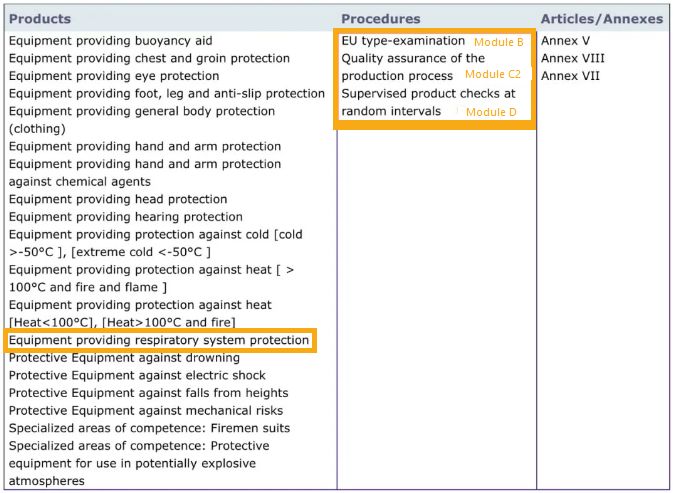
法规共有九大类产品授权,认证公告机构的授权范围也不同,如果不具备呼吸防护的小类,即使是PPE认证公告机构,也不能从事防护口罩的CE认证活动。
查询方法,在官网上点开PPE授权右侧的“HTML”或“PDF”链接,看到下图查看是否有呼吸防护的小类授权,并具备完整的Module B、C2和/或D资质,才有权签发Module B、C2和/或D证书。授权展示如下图橙框所示:
以上图片来源:欧盟官网及美国CDC网站
制造商只有在获得Module B + Module C2证书或Module B + Module D证书后,才可以进入欧盟市场合法销售。
如果认证认证公告机构只有部分Module B、C2或D的授权,那么他是没有权力签发无认可资质的证书的,企业持有其证书,也无法在欧盟市场合法销售。
从目前查询信息,
(EU)2016/425公告机构,能发呼吸防护的机构有:
SGS NB0598,SGS NB0120
SGS是欧盟PPE个体防护装备法规(EU)2016/425公告机构(NB 0598,NB0120),可开展法规下的测试、技术文件审核以及CE认证工作,范围包含所有个体防护装备,提供包括口罩、防护服、防护手套、安全鞋等供应商的资质审查、检验标准设立、实地验厂、抽样检查等服务。
MDR法规(EU)2017/745授权
MDD指令将于2020年5月25日作废,取而代之的是MDR法规的强制实施。由于临近MDR实施期限,在此我们只讨论MDR的产品授权。
MDR覆盖了基本所有医疗器械的范围,但各公告机构的授权范围不一定相同,这取决于公告机构的技术能力和资源。如果公告机构不具备医用灭菌口罩、医用无菌隔离衣、额温枪、电子体温计等相关医疗器械的授权,即使是MDR授权的公告机构,也不能从事这类产品的CE认证活动。
制造商只有在获得MDD CE证书或MDR CE证书后,上述产品才可以进入欧盟市场合法销售。
以上干货由SGS专家解读,小编整理发布。
同时,还可以参加我们举办的【疫情防控物资出口法规及市场准入】在线培训课程
权威专家在线解读口罩、防护服、红外线体温计、试剂盒、护目镜及隔离面罩、防护手套紧急上市,要面对的法规要求和检测标准,以帮助企业了解相关法规要求,掌握识别不同法规的能力,最终达到抗疫物资快速出口、合规上市!
直播当天限时免费(第二天收费模式),机会难得,快扫码报名吧

除此之外,SGS独家推出口罩标准全球包:
集SGS全球标准合规团队的力量,将口罩全球适用标准进行了整理和分析,特推出口罩标准-全球包。以帮助口罩生产企业了解各国口罩标准要求,掌握标准条款,合规生产,提升效率,符合标准要求,快速上市。
口罩标准-全球包(全球适用正版电子版标准)
|
序号 |
中国标准 |
ASTM |
ISO |
EN |
|
1 |
GB19083 |
ASTM F 1862 |
ISO10993-5:2009 |
BS EN14683:2019 |
|
2 |
GB2626 |
ASTM F 2101 |
ISO10993-10:2009 |
_ |
|
3 |
YY0469 |
ASTM F 2299 |
ISO13485:2016 |
_ |
|
4 |
YY/T0969 |
_ |
ISO10993-1:2009 |
_ |
|
5 |
YY/T1497 |
_ |
ISO22609:2004 |
_ |
|
6 |
GB/T32610 |
_ |
_ |
_ |
|
7 |
YY/T0866 |
_ |
_ |
_ |
全球包价格
RMB 25,800.00(通过本文报名可享受9折优惠)
服务内容
所有正版电子版标准
所有标准中英文翻译文本
风险管理一点通标准数据库1年使用权限
快扫描抢先购买,您提交购买信息后,SGS工作人员会跟您联系。

16th Floor, Block A, No.73 Fucheng Road, Century Yuhui Mansion,
北京, Haidian District, 中国大陆



